TERMODINAMICA
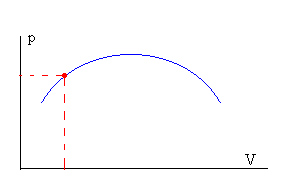
Denominamos estado de equilibrio de un sistema cuando las variables macroscópicas presión p, volumen V, y temperatura T, no cambian. El estado de equilibrio es dinámico en el sentido de que los constituyentes del sistema se mueven continuamente.
El estado del sistema se representa por un punto en un diagrama p-V. Podemos llevar al sistema desde un estado inicial a otro final a través de una sucesión de estados de equilibrio.
|
Se denomina ecuación de estado a la relación que existe entre las variables p, V, y T. La ecuación de estado más sencilla es la de un gas ideal pV=nRT, donde n representa el número de moles, y R la constante de los gasesR=0.082 atm·l/(K mol)=8.3143 J/(K mol).
Se denomina energía interna del sistema a la suma de las energías de todas sus partículas. En un gas ideal las moléculas solamente tienen energía cinética, los choques entre las moléculas se suponen perfectamente elásticos, la energía interna solamente depende de la temperatura.
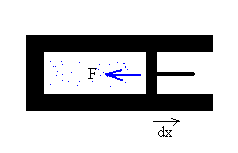

Trabajo mecánico
Consideremos, por ejemplo, un gas dentro de un cilindro. Las moléculas del gas chocan contra las paredes cambiando la dirección de su velocidad, o de su momento lineal. El efecto del gran número de colisiones que tienen lugar en la unidad de tiempo, se puede representar por una fuerza F que actúa sobre toda la superficie de la pared.

El calor
El calor no es una nueva forma de energía, es el nombre dado a una transferencia de energía de tipo especial en el que intervienen gran número de partículas. Se denomina calor a la energía intercambiada entre un sistema y el medio que le rodea debido a los choques entre las moléculas del sistema y el exterior al mismo y siempre que no pueda expresarse macroscópicamente como producto de fuerza por desplazamiento.
Primera ley de la Termodinámica
La primera ley no es otra cosa que el principio de conservación de la energía aplicado a un sistema de muchísimas partículas. A cada estado del sistema le corresponde una energía interna U. Cuando el sistema pasa del estado A al estado B, su energía interna cambia en DU=UB-UA

Transformaciones
La energía interna U del sistema depende únicamente del estado del sistema, en un gas ideal depende solamente de su temperatura. Mientras que la transferencia de calor o el trabajo mecánico dependen del tipo de transformación o camino seguido para ir del estado inicial al final.
Esta ley, en combinación con la primera ley de la termodinámica, pronostica la dirección que siguen los procesos naturales y las situaciones de equilibrio. A partir de la segunda ley de la termodinámica se establece la imposibilidad de convertir totalmente una cantidad de calor (energía de baja calidad) en trabajo (energía de máxima calidad). Lo anterior puede resumirse así: “la calidad de la energía se destruye en los procesos con flujo de calor, lo cual esta en concordancia con el principio del aumento de entropía del universo: dS > 0.

Segunda ley de la termodinámica

No hay comentarios:
Publicar un comentario